Когда рак молочной железы (РМЖ) распространяется по организму, он может разрушить здоровые кости пациента, вызывая множество проблем. Учёные из Института рака Хантсмана (Huntsman Cancer Institute) при Университете Юты (University of Utah) обнаружили новый механизм, лежащий в основе метастатического поражения костей. Они также выяснили, как заблокировать его при помощи лекарственного средства. Предварительные результаты испытаний нового препарата выглядят многообещающе.
Результаты исследования были опубликованы в издании Science Translational Medicine (Andrade et al., RON kinase: A target for treatment of
Ежегодно около 400 тыс. человек по всему миру погибают, поскольку рак молочной железы распространился по организму. Приблизительно при 75% случаев метастатического РМЖ присутствуют поражения костей.
Руководительница исследования Алана Вельм (Alana Welm), доцент онкологии Университета Юты, поясняет: «Когда рак груди распространяется в кóсти, он разрушает их. Процесс при этом сходен с развитием остеопороза, но он гораздо масштабнее. Рак разъедает костную ткань, в буквальном смысле слова приводя к появлению дыр в скелете».
Пациенты при этом страдают от боли и переломов. Если метастазы проникли в позвоночник, позвонки могут разрушиться, что приведёт к компрессии спинного мозга.
Чтобы изучить процесс поражения костной ткани, Вельм и её коллеги ввели опухолевые клетки в костную ткань мышей. Кости подопытных животных начали разрушаться, что, в целом, не характерно для мышей. Затем учёные обнаружили, что некоторые клетки РМЖ выделяют белок, стимулирующий макрофаги. Этот белок захватывался так называемым «белком RON», что и заставляло клетки кости секретировать кислоту, разрушающую костную ткань.
Выяснив механику процесса, учёные вывели линию мышей, у которых отсутствовал ген, ответственный за синтез белка RON. Таким образом они планировали выяснить, что произойдёт в отсутствие рецептора к белку, стимулирующему макрофаги.
«Мы обнаружили, что это защищает кости от распада, — рассказывает Вельм. — Процесс разрушения замедлился, возможно, в 10 раз, практически полностью остановился. Даже если опухолевые клетки проникали в костную ткань, кости мыши сохранялись намного лучше».
Но человеческие гены нельзя просто «выкинуть». Поэтому учёные обратились за помощью к биотехнологической компании, которая занималась разработкой ингибитора белка RON. Препарат был протестирован на мышах — и вновь результат был положительным. Животные дольше могли перемещаться на собственных лапах и меньше страдали от переломов.
Компания к этому моменту начала проведение клинических испытаний I фазы. Вельм и её коллеги присоединились к этому исследованию, чтобы изучить влияние препарата на кости людей. Но, так как основной целью испытаний была оценка безопасности нового лекарства, количество участников было небольшим. В группу вошли как мужчины, так и женщины, страдавшие различными онкологическими заболеваниями. Метастатических поражений костей не было ни у одного из участников. Однако почти все добровольцы были старше 50 лет, а значит, у них могли развиться возрастные нарушения костного метаболизма. А у нескольких женщин уже начал прогрессировать остеопороз. Результаты испытаний оказались обнадёживающими.
Метаболизм (ремоделирование) костной ткани характеризуется двумя противоположными процессами: образованием новой костной ткани и резорбцией (деградацией) старой. Масса кости зависит от баланса между резорбцией и образованием кости в конкретный период времени. В норме количество новой ткани эквивалентно разрушенной. При всех заболеваниях скелета происходят нарушения процессов ремоделирования кости, что сопровождается отклонениями в уровне биохимических маркеров.
«Мы смогли изучить образцы крови участников исследования до начала терапии и через 28 и более дней приёма препарата. И мы видели, как уменьшается количество маркеров возрастных нарушений костного метаболизма, — поясняет Вельм. — Почти в двух третьих случаев мы видели, как снижаются показатели, связанные с разрушением костной ткани. И приблизительно у такого же числа пациентов повысилась концентрациям маркеров, указывающих на восстановление костей».
У женщин эффект был более заметным, возможно, за счёт того, что в постменопаузальном периоде нарушения обновления костной ткани более выражены. После первого месяца терапии у 72% пациенток активность процессов разрушения кости снизилась на 25%.
Препарат хорошо переносился, количество побочных эффектов было небольшим. Результаты испытаний I фазы выглядят обнадёживающе. Но теперь требуется следующий шаг — исследование эффективности нового лекарства непосредственно при РМЖ. Поскольку не все типы опухолей груди выделяют белок, стимулирующий макрофаги, учёные планируют сосредоточиться на пациентах, у которых уровень этого белка высок.
По данным исследователей, белок, стимулирующий макрофаги, секретируется опухолевыми клетками РМЖ приблизительно в 40% случаев. «Если мы сможем помочь 40% пациентов с метастатическим раком груди — это огромный шаг вперёд. Даже если я увижу, что наша работа помогла
Исследовательница считает, что новый препарат может хорошо работать в комбинациях с уже известными средствами, особенно у пациентов, резистентных к существующим методам лечения. Также она надеется, что средство будет эффективно при других типах рака, поражающих костную ткань, и при остеопорозе.
Портал «Вечная молодость» http://vechnayamolodost.ru
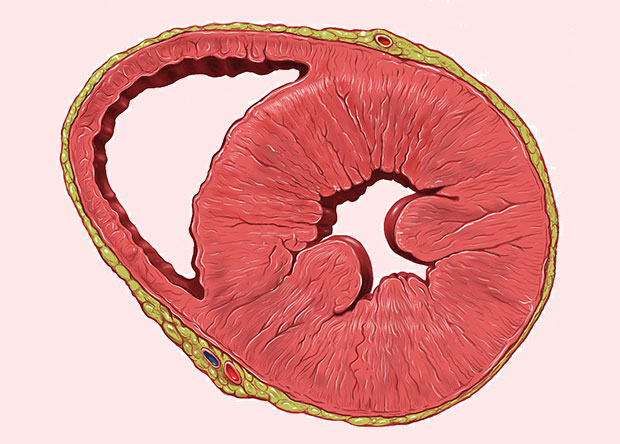 Поперечный срез сердца с гипертрофией левого желудочка (Wikimedia Commons)
Поперечный срез сердца с гипертрофией левого желудочка (Wikimedia Commons)






 Атеросклероз представляет собой пример хронического заболевания, в котором задействованы воспалительные механизмы. Увеличение численности лейкоцитов в крови характеризует начало этого заболевания. Болезнь развивается при участии разнообразных медиаторов воспаления, которые находятся под влиянием клеток врожденного и приобретенного иммунитета
Атеросклероз представляет собой пример хронического заболевания, в котором задействованы воспалительные механизмы. Увеличение численности лейкоцитов в крови характеризует начало этого заболевания. Болезнь развивается при участии разнообразных медиаторов воспаления, которые находятся под влиянием клеток врожденного и приобретенного иммунитета
 Воспаление — это часть комплексного биологического ответа тканей организма на вредные воздействия, например, на патогенные организмы, поврежденные клетки или другие раздражители.
Воспаление — это часть комплексного биологического ответа тканей организма на вредные воздействия, например, на патогенные организмы, поврежденные клетки или другие раздражители. Старение человека характеризуется хроническим слабо выраженным системным воспалением, и это явление получило название «воспаление старения». Воспаление старения является высоко значимым фактором риска как возникновения осложнений болезней, так и смертности у пожилых людей, поскольку большинство, если не все болезни, связанные со старостью, имеют воспалительный патогенез. Среди таких болезней можно назвать атеросклероз, болезнь Альцгеймера и рак.
Старение человека характеризуется хроническим слабо выраженным системным воспалением, и это явление получило название «воспаление старения». Воспаление старения является высоко значимым фактором риска как возникновения осложнений болезней, так и смертности у пожилых людей, поскольку большинство, если не все болезни, связанные со старостью, имеют воспалительный патогенез. Среди таких болезней можно назвать атеросклероз, болезнь Альцгеймера и рак.

 Изменения, происходящие с возрастом в клеточном обмене веществ, и, особенно, в метаболических путях образования энергии, часто ведут к заболеваниям или ускорению процесса старения, в частности, к развитию диабета, жировой дистрофии печени,
Изменения, происходящие с возрастом в клеточном обмене веществ, и, особенно, в метаболических путях образования энергии, часто ведут к заболеваниям или ускорению процесса старения, в частности, к развитию диабета, жировой дистрофии печени,  Процесс старения характеризуется тем, что нарушения обмена веществ постепенно нарастают. Эти нарушения включают резистентность к инсулину, физиологическое сокращения уровня гормона роста (GH), инсулиноподобного фактора
Процесс старения характеризуется тем, что нарушения обмена веществ постепенно нарастают. Эти нарушения включают резистентность к инсулину, физиологическое сокращения уровня гормона роста (GH), инсулиноподобного фактора  Резистентность к инсулину является главной составляющей метаболического синдрома и очень часто наблюдается у пожилых людей. Метаболический синдром проявляется увеличением глюконеогенеза в печени, увеличением образования жировой ткани, нарушениями синтеза гликогена и усвоения глюкозы в скелетной мускулатуре. Брюшное ожирение, которое очень часто развивается при старении, вносит основной вклад в развитие метаболического синдрома.
Резистентность к инсулину является главной составляющей метаболического синдрома и очень часто наблюдается у пожилых людей. Метаболический синдром проявляется увеличением глюконеогенеза в печени, увеличением образования жировой ткани, нарушениями синтеза гликогена и усвоения глюкозы в скелетной мускулатуре. Брюшное ожирение, которое очень часто развивается при старении, вносит основной вклад в развитие метаболического синдрома. Старение также связано с возрастанием количества провоспалительных цитокинов, которые также взаимодействуют с инсулином. Возрастание количества этих цитокинов связано как висцерального жира, которое происходит в пожилом возрасте, так и с синтезом провоспалительных цитокинов стареющими клетками. Перечисленные возрастные изменения обмена веществ и распределения жировой ткани в организме ускоряют старение и проявление различных болезней.
Старение также связано с возрастанием количества провоспалительных цитокинов, которые также взаимодействуют с инсулином. Возрастание количества этих цитокинов связано как висцерального жира, которое происходит в пожилом возрасте, так и с синтезом провоспалительных цитокинов стареющими клетками. Перечисленные возрастные изменения обмена веществ и распределения жировой ткани в организме ускоряют старение и проявление различных болезней.



 Напротив, ряд важных генов, например, гены рецепторов половых гормонов, теломеразы, репарации ДНК в некоторых тканях испытывают избирательное гиперметилирование. Этот вид эпимутации приводит к отключению функции данного гена. Причины возрастного гиперметилирования пока не ясны. Но уже сегодня понятно, что управление процессом метилирования может дать один из подходов к управлению старением.
Напротив, ряд важных генов, например, гены рецепторов половых гормонов, теломеразы, репарации ДНК в некоторых тканях испытывают избирательное гиперметилирование. Этот вид эпимутации приводит к отключению функции данного гена. Причины возрастного гиперметилирования пока не ясны. Но уже сегодня понятно, что управление процессом метилирования может дать один из подходов к управлению старением.