Ксения Перфильева, «Элементы», по статье «3D-биопринтинг микроокружения опухоли: последние достижения» (Тимофеева и др., Журнал общей биологии, 2021).
3D-принтинг позволяет создавать живые объекты с заданными характеристиками с желаемым клеточным составом. Такие модели живых тканей (органов) открывают путь к исследованию взаимодействий между клеточными элементами и межклеточной средой в условиях, приближенных к функционированию в живом организме. Известно, что микроокружение опухоли оказывает значительное влияние на скорость ее развития, а также на способность противостоять противоопухолевым агентам. В статье рассмотрены методы создания и исследования 3D-моделей различных вариантов микроокружения опухолей и самих опухолевых клеток.
Создать жизнь в пробирке – давняя мечта человека – пока еще не осуществлена, но вот возможность сделать в чашке Петри необходимые человеку собственные «запчасти» на смену пришедшим в негодность, пожалуй, становится реальностью. Официально технология создания объемных моделей живых клеточных тканей и органов, при которой сохраняются жизнеспособность и функции клеток, была впервые запатентована в США в 2006 (хотя люди уже были знакомы с более продвинутой технологией печати живого человека по последовательности ДНК благодаря талантливым творцам виртуальной реальности.

Люк Бессон не так уж и промахнулся в 1997(!), создав киношный 3D-биопринтер для печати идеального человека (кадр из фильма «Пятый элемент»).
3D-биопринтинг, вчерашняя фантазия, в настоящее время реальная биомедицинская технология позволяющая создавать не только относительно простые и однородные живые объекты – ткани с небольшим набором разных типов клеток, но даже целые органы с сосудами (рис. 1). Объект в буквальном смысле печатается в готовом виде, т.е. не требуется его долго выращивать, как в классической культуре клеток, хотя функционирование такого объекта и предполагает его дальнейшее развитие. Чернилами (биочернилами) выступает специальная среда с живыми клетками, которая обеспечивает заданную механическую прочность и способна поддерживать жизнеспособность клеток.

Рис. 1. (A – C) Суспензионная среда, используемая в качестве технологического средства для трехмерной биопечати сердца человека и пример 3D-биопечати, миниатюрного человеческого сердца из кардиомиоцитов, эндотелиальных клеток и внеклеточный матрикса человека. (D) Сердце, напечатанное на 3D-принтере, извлеченное из среды, затем перфузированное красным и синим красителями, чтобы продемонстрировать полые камеры внутри конструкции даже содержит несколько сосудов. Размер шкалы 1 мм. Детали см. здесь.
Можно использовать несколько типов биочернил, объединяя их в гетерогенный объект. Существует три основных метода различных модификаций 3D-биопринтинга, т.е. печати: струйный, лазерный и печать на основе экструзии (рис. 2), но также разрабатываются другие методы. Разнообразные методы печати способны контролировать структуру получаемых «живых объектов» на нано уровне, до отдельных клеток. Таким образом, появилась уникальная возможность соединять живые элементы тканей в любых комбинациях и изучать их взаимодействия в приближенных к нативным условиям.
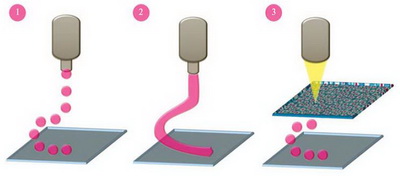
Рис. 2. Основные методы 3D-биопринтинга: 1 – струйный, 2 – экструзионный, 3 – лазерный (иллюстрация из обсуждаемой статьи).
Одним из важных актуальных и уже работающих на данный момент направлений применения технологий 3D-биопринтинга является исследование действия косметических и лекарственных препаратов на живые ткани не только без привлечения к испытаниям живых организмов, но непосредственно на тканях человека. В обсуждаемой статье авторы представили обзор по созданию и изучению моделей микроокружения злокачественных опухолей человека, воссозданных на основе 3D-биопринтинга. Клеточное окружение опухоли (ангиогенные сосудистые, инфильтрирующие иммунные, эндотелиальные, стромальные клетки) и внеклеточный матрикс (белки матрикса, сигнальные молекулы, факторы роста и проч.) представляют собой разнородную среду (микроокружение опухолей), свойства которой могут способствовать или затормаживать рост опухоли. Многофакторность процессов осложняется наличием индивидуальных особенностей в протекании болезни у разных людей. Изучение взаимодействий между всеми элементами живого объекта на 3D-моделях поможет найти подходы для индивидуального лечения злокачественных опухолей, поскольку опухоль каждого пациента уникальна в силу индивидуальных (в том числе генетических) особенностей человека. Одно из удивительных преимуществ 3D-биопринтинга в возможности интеграции в состав моделей кровеносных сетей, которые исключительно важны в процессах формирования опухоли, поскольку обеспечивают интенсивность доставки кислорода и питательных веществ. К настоящему моменту удалось создать жизнеспособные 3D-модели для нескольких типов рака: молочной железы (РМЖ), кожи, легкого, печени, яичников, шейки матки, колоректальный, глиобластомы. Создание моделей почти творческий процесс. Биочернила на сегодняшний день не стандартизированы, собственно и клеточный материал, используемый для биопринтинга, тоже должен быть уникальным.
Так, например, одна из моделей на основе костного матрикса и гидрогеля была создана для исследования взаимодействия опухолевых клеток РМЖ и мезенхимальных стволовых клеток (рис.3). На ней было показано, что в этой «двухкомпонентной» системе происходит ускорение роста числа клеток опухоли и одновременное снижение пролиферации (деления) мезенхимальных клеток.
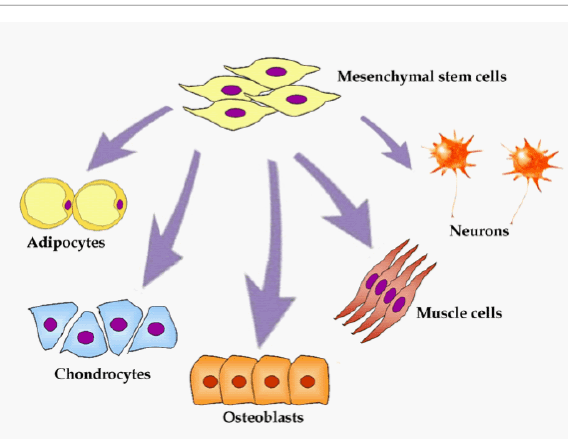
Рис. 3. Мезенхимальные стволовые клетки (МСК) – это мультипотентные клетки, которые могут делиться и дифференцироваться в различные типы клеток, в том числе остеобласты, хондроциты, миоциты, адипоциты, и, возможно, другие типы клеток.
В другом эксперименте 3D-модель с использованием культуры клеток РМЖ и стволовых клеток, полученных из жировой ткани, исследовали воздействие противоопухолевого агента (доксорубицин). 3D-модель представляла собой диск, в центре которого располагались опухолевые клетки, а по краям – клетки жировой ткани. В эксперименте варьировали толщину слоя с жировыми клетками. Показано, что увеличение этого слоя приводило к повышению устойчивости клеток опухоли к противоопухолевому препарату. Удачными оказались попытки создания гетерогенных 3D-моделей с разными типами клеток (опухолевые, фибробласты, мезенхимные стволовые, жировые и др.).
В целом, все эксперименты продемонстрировали большую устойчивость опухолевых клеток в 3D-моделях по сравнению с классическими культурами (2D-модели). Основные перспективы развития исследований ожидаются, очевидно, в нескольких направлениях: подбор и создание биочернил с заданными свойствами, а также их стандартизация для последующего использования в экспериментах; получение разнородного клеточного материала для создания различных опухолевых 3D-моделей, собственно исследование процессов в разнокомпонентных опухолевых моделях и воздействия лекарственных препаратов на них.
Портал «Вечная молодость» http://vechnayamolodost.ru


