В 1987 году японские ученые обнаружили в геномах бактерий участки с регулярной структурой — короткие одинаковые последовательности чередовались с уникальными фрагментами, которые у разных бактерий не имели ничего общего. Такие участки назвали CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats). Спустя 10 лет удалось доказать, что эти участки отвечают за адаптивный иммунитет бактерий, а в уникальных последовательностях — спейсерах — хранится информация о геномах вирусов, против которых бактерия умеет бороться. РНК, которая синтезируется с таких участков, в комплексе с белками Cas уничтожает соответствующую ДНК вирусов, если они атакуют клетку. А самое замечательное, что бактерия может пополнять свою библиотеку вирусной ДНК, когда встречается с незнакомыми патогенами [1]. Именно поэтому иммунитет CRISPR адаптивный — он совершенствуется и учится противостоять новым типам инфекции. CRISPR — это интересный пример эволюции по Ламарку: события жизни организма непосредственно влияют на его ДНК, изменяя ее так, что организм становится более приспособленным. С другой стороны, CRISPR интересны для прикладной науки — оказалось, что, снабдив белки Cas произвольной РНК, можно заставить их расщепить ДНК клеток в соответствующем месте*.
- — Ранее «биомолекула» неоднократно писала о достижениях в области использования CRISPR/
Cas-систем для редактирования генома: «CRISPR-системы : иммунизация прокариот», «Мутагенная цепная реакция: редактирование геномов на грани фантастики» и «Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик» [2–4]. — Ред.
С помощью таких систем можно просто и точно редактировать геномы самых разных клеток (оказалось, что бактериальные CRISPR хорошо работают и в клетках эукариот). Возможности CRISPR настолько замечательны, что редкий номер авторитетного журнала сегодня обходится без статьи, разъясняющей новые подробности работы этих систем или рассказывающей о новом их применении.
Хотя никто уже не сомневается, что CRISPR способны на многое, 26 февраля 2016 года в Science вышла статья, рассказывающая о типе этих систем с новыми, еще более невероятными возможностями [5]. Оказалось, что некоторые из
На мысль, что такая возможность у бактерий должна быть, ученых навели некоторые сделанные ранее наблюдения.
Чтобы проверить свои догадки, ученые выбрали CRISPR систему легко культивируемых бактерий Martelella mediterranea. В ее составе обнаружился химерный белок с функциями Cas1 и обратной транскриптазы. Чтобы за работой белка было удобнее наблюдать, исследователи получили трансгенные штаммы бактерий с дополнительной копией гена химерного белка, поставленной под сильный промотор. При этом белок с функциями Cas1 и обратной транскриптазы нарабатывался клетками в огромных количествах. В таких условиях в кассеты CRISPR начинали встраиваться новые фрагменты, совпадающие с собственным генетическим материалом бактерии (рис. 1). При этом чаще всего в кассеты встраивались фрагменты тех участков ДНК, что наиболее активно транскрибировались. Эти данные косвенно подтверждали участие РНК в сохранении информации в память CRISPR, но не могли считаться прямым доказательством роли РНК в образовании новых спейсеров. Например, система CRISPR могла предпочтительно использовать ДНК активно транскрибируемых генов, потому что такая ДНК очищается от белков, и компонентам CRISPR могло быть удобнее к ней подойти.
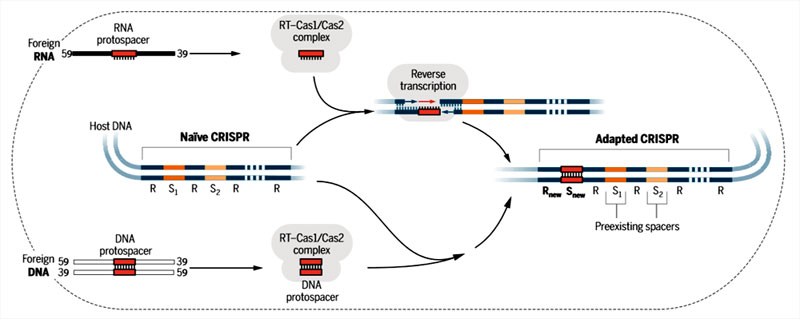
Рисунок 1. Схема встраивания новых спейсеров в
Чтобы прояснить вопрос о роли РНК в формировании новых вставок, ученые синтезировали специальную последовательность ДНК, кодирующую самосплайсирующуюся РНК. Такая РНК способна вырезать из самой себя определенный фрагмент. Поэтому вариант молекулы, записанный в ДНК, отличался от
Интересно, что при использовании гена со сломанным доменом обратной транскриптазы бактерии не прекращали вставлять в
Новый тип систем CRISPR можно считать первым обнаруженным примером адаптивного использования обратной транскрипции клеточными формами жизни. Интересно будет поставить эксперименты, которые позволят количественно оценить влияние такого типа иммунитета на выживаемость бактерий, противостоящих инфекции. Хотя система может помочь бактерии нацелиться именно на те гены, что работают у патогена активнее всего, у нее есть и недостаток — уже упомянутое отсутствие направленного ориентирования при встраивании фрагментов РНК в кассеты CRISPR. При этом получается, что около половины спейсеров, полученных на базе РНК, будут расположены задом наперед и будут направлять иммунную систему бактерий искать несуществующие мишени.
Как бы то ни было, новые данные дополнили наши знания о механизмах работы
Литература
- Sontheimer E.J. and Marraffini L.A. (2016). CRISPR goes retro. Science. 351, 920–921;
-
биомолекула: «
CRISPR-системы : иммунизация прокариот»; - биомолекула: «Мутагенная цепная реакция: редактирование геномов на грани фантастики»;
- биомолекула: «Вылечить миодистрофию Дюшенна: конкуренция групп, единство методик»;
-
Silas S., Mohr G., Sidote D.J., Markham L.M.,
Sanchez-Amat A., Bhaya D. et al. (2016). Direct CRISPR spacer acquisition from RNA by a natural reversetranscriptase-Cas1 fusion protein. Science. 351, aad4234.
Юлия Кондратенко, «Биомолекула»
Портал «Вечная молодость» http://vechnayamolodost.ru


