Разработана принципиально новая стратегия адресной доставки противораковых лекарств
Международная группа ученых разработала новую стратегию адресной доставки соединений для терапии и диагностики раковых заболеваний, которая позволяет значительно повысить как эффективность диагностики, так и лечения агрессивных метастазирующих опухолей. Исследователи создали два «оружия», бьющие в одну цель, и, тем самым, в 1000 раз снизили концентрацию действующих веществ для достижения того же терапевтического эффекта, что и при стандартном лечении одним препаратом. Тестирование разработки проходило на животных. Результаты исследования опубликованы в журнале ACS Nano. Работа поддержана грантами Президентской программы Российского научного фонда (РНФ).
«Обеспечивая эффективную доставку терапевтических агентов в область опухоли, технология двойного нацеливания на одну мишень – белок на поверхности раковых клеток – позволяет значительно снизить эффективную концентрацию лекарства для достижения того же эффекта. Ожидается, что такое снижение дозы сведет к минимуму побочные эффекты, которые могут быть очень серьезными при применении неспецифических химиотерапевтических препаратов, ограничивающих выбор последующих планов лечения. С другой стороны, использование наших разработок для адресной доставки приводит к низкому иммунному ответу организма, что позволит в случае необходимости повторить курс терапии. Кроме того, предлагаемая технология предлагает путь для высокоэффективного лечения в течение очень короткого периода времени, что очень важно для предотвращения метастазов в быстро развивающихся новообразованиях», – комментирует Виктория Шипунова, первый автор статьи, руководитель проекта по гранту РНФ, кандидат биологических наук, старший научный сотрудник Лаборатории молекулярной иммунологии Института биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова РАН (ИБХ РАН, Москва).
По данным Минздрава, сейчас в России живут 3,7 млн человек, больных каким-либо онкологическим заболеванием (около 2,6 тыс. случаев на 100 тыс. населения). Онкологические заболевания – одни из самых серьезных проблем биологии и медицины – требуют диагностики и вмешательства на самых ранних стадиях развития, что особенно критично в случае развития агрессивных метастазирующих опухолей. Для борьбы с этими заболеваниями традиционно применяют химиотерапевтические препараты широкого спектра (не нацеленные только на опухоль), такие как доксорубицин, паклитаксел, метотрексат и другие, которые приводят к целому ряду серьезных побочных эффектов. Чтобы понизить системную токсичность и повысить терапевтическую эффективность, часто используют различные виды комбинированной терапии, например, объединение химиотерапии, лучевой терапии, клеточной терапии и/или иммунотерапии.
Кроме того, эффективность лечения можно повысить за счет использования наночастиц разной природы. Они представляют собой идеальную платформу для доставки терапевтических соединений непосредственно к клеткам опухоли. Для этого поверхность наночастиц покрывают распознающими молекулами, приводящими наночастицы точно «в цель» и минимизирующими побочные эффекты для организма.
Многообещающий подход для тераностики рака (диагностики и терапии при использовании одного соединения) – комбинация иммунотерапии и направленной доставки химиотерапевтических соединений, например, с использованием наночастиц. Однако этот подход сегодня демонстрирует лишь ограниченный успех в связи с рядом проблем, таких как низкий терапевтический индекс традиционной химиотерапии, отсутствие широкого спектра онкомаркеров на поверхности клеток и других факторов.
«В опубликованной работе мы разработали стратегию синергичной комбинированной адресной иммуно/химиотерапии: мы нацеливаем препараты на разные участки одного рецептора – онкомаркера HER2 на поверхности клеток. HER2 – клинически значимый онкомаркер, повышенное количество которого на поверхности клеток часто ассоциировано с устойчивостью к химиотерапии, высоким метастазированием и плохим прогнозом», – отмечает Виктория Шипунова.
Ученые нацелили на опухоль сразу два компонента. Во-первых, наночастицы полилактида-ко-гликолида – сополимера молочной и гликолевой кислот, то есть композита из веществ, которые есть в организме человека. Шарики-наночастицы «заправили» химиопрепаратом доксорубицином, а также адресным полипептидом – аффинной молекулой, позволяющей увидеть, что происходит в организме после запуска препарата.
В качестве второго компонента использовали фрагмент токсина из синегнойной палочки, связанного с другим адресным полипептидом, узнающим онкомаркер HER2. Этот полипептид – дарпин9.29 – связывает другой участок рецептора HER2, не конкурируя за место связывания с аффинными молекулами.
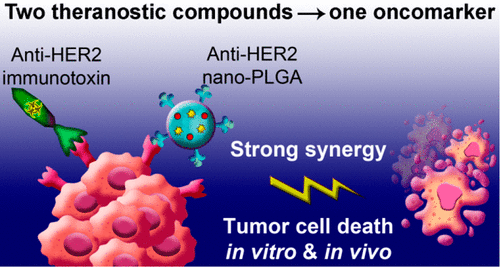
В своей работе ученые впервые использовали адресные скаффолдовые полипептиды, чтобы нацелиться на один онкомаркер – HER2. Скаффолдовые полипептиды – новый популярный класс нацеливающих соединений, который используют вместо традиционных полноразмерных антител. Они меньше, реже вызывают нежелательный ответ иммунитета, хорошо растворимы и стабильны в экстремальных условиях, а также гораздо легче и дешевле синтезируются в биореакторах, что немаловажно для их дальнейшего массового применения в биомедицине.
«Использование двух адресных суперструктур позволило в 1000 раз снизить концентрацию действующих веществ для достижения того же терапевтического эффекта. Более того, комбинация этих препаратов действует синергично, то есть одно вещество значительно усиливает действие другого. Это особенно удивительно и неожиданно, поскольку оба препарата воздействуют всего на один клеточный рецептор. Такая синергия позволила значительно усилить эффективность терапии HER2-позитивных опухолей у животных и полностью предотвратить появление метастазов», – рассказывает Виктория Шипунова.
В работе ученые для тестирования своих разработок использовали иммунодефицитных мышей, у которых нет тимуса, что приводит к низкому количеству защитных клеток организма – T-лимфоцитов. Таким мышам подсаживали человеческие раковые клетки, несущие на себе человеческий онкомаркер HER2, и отсутствие достаточных защитных сил иммунитета мышей позволило этим клеткам «прижиться» в мышином организме и сформировать метастазирующую опухоль. Соответственно, исследователи получили удобную модель для доклинических исследований злокачественного роста – у мышей формировались опухоли, напоминающие человеческие и реагирующие на лечение так же, как реагировали бы человеческие раковые клетки.
Поскольку разработанные препараты – разны по происхождению и значению, они выводятся из организма разными путями: наночастицы – через печень или селезенку, белки – через почки. Таким образом, комбинируя лечебные средства и снижая их концентрацию, можно добиться минимизации воздействия на органы («перераспределив» общую сильную нагрузку, например, на печень, между всеми органами в гораздо меньшей дозе) и кардинального уменьшения побочных эффектов, что очень важно для разработки эффективных стратегий онкотераностики.
«Разработанная стратегия двойного нацеливания, подразумевающая «два агента – один рецептор» – большой шаг на пути к разработке эффективных методов лечения агрессивных опухолей. Эту стратегию можно распространить на другие комбинированные методы лечения и противоопухолевые мишени», – полагает Сергей Деев, доктор биологических наук, профессор, академик РАН, руководитель исследования, заведующий лабораторией молекулярной иммунологии, где была выполнена основная часть работы.
Исследования проводились также в сотрудничестве с Инженерно-физическим институтом биомедицины НИЯУ МИФИ и Институтом лазеров, фотоники и биофотоники Университета штата Нью-Йорк в Буффало (США). Эксперименты по биовизуализации опухолей в лабораторных мышах проводили с использованием оборудования ЦКП ИБХ РАН.
Пресс-служба РНФ
Портал «Вечная молодость» http://vechnayamolodost.ru


