Мутация в гене
Механизм ускорения старения под действием
Физическая активность у животных
Яйцеклетки с возрастом накапливают карбонилированные (окисленные) белки. Оплодотворение яйцеклетки сперматозоидом приводит к увеличению кислотности лизосом, активизации митофагии поврежденных митохондрий. В результате снижается образование свободных радикалов и уменьшается карбонилирование. Увеличение кислотности связано с повышением экспрессии гена лизосомальной протонной помпы
Джон Седиви (Brown University)
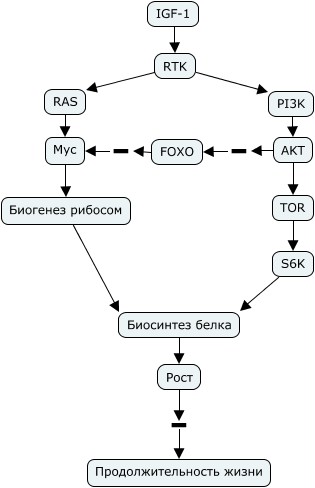
Мыши, гетерозиготные по мутации гена транскрипционного фактора myc (±) живут на 15% дольше. Они мельче в размерах, здоровее, меньшее количество генов меняет свою экспрессию при их старении, при этом смертность от рака у них не меняется, хотя myc является онкогеном. У них меньше остеопорозов, стенозов, фиброзов сердца, ниже синтез холестерина, выше уровень метаболизма и физической активности, они больше едят, выше соотношение наивных
Мэт Каберлейн (Вашингтонский университет)
Нейродегенерация на модели мышей с митохондриальным заболеванием синдромом Лея облегчается ингибитором
Трехмесячная ежедневная инъекция 8 мг/кг массы тела рапамицина старым мышам привела к увеличению продолжительности жизни самцов. 9x ITP transient исследование рапамицина увеличивало продолжительность жизни не только самцов, но и у самок мышей.
Мануэль Серрано (Испанский нацональный центр исследования рака).
Изучал 4K репрограммирование старых фибробластов кожи человека.
Сенолитики — соединения, прицельно уничтожающие сенесцентные клетки. К ним относятся navitoclax (ABT263) и
Генри Джаспер (Институт Бака)
При действии инфекции на стенки кишечника дрозофил в стволовых клетках активизируется JAK/STAT сигнальный путь и затем piwi, что способствует поддержанию тканевого гомеостаза и регенерации. Утрата piwi вызывает активизацию ретротранспозонов в кишечных стволовых клетках. В старых стволовых клетках кишечника как раз происходит активизация ретротранспозонов. Сверхэкспрессия piwi у мух подавляет нарушение дифференцировки стволовых клеток кишечника при старении. Напротив, Tor способствует дифференцировке стволовых клеток и тем самым — истощению их пула.
Дж. Дохла (Университет Хельсинки)
при делении мезенхимальных стволовых клеток человека наблюдается асимметричное распределение старых митохондрий. Дочерние клетки, теряющие такие митохондрии, более похожи на стволовые клетки, чем на дифференцирующеся. Митохондрии в клетке регулярно проходят циклы слияния (fusion) и расщепления (fission). Для сегрегации старых митохондрий при делении стволовой клетки необходимым является процесс расщепления.
Т. Хоппе (Кельнский университет)
Старение выражается в том числе в нарушении соотношения денатурированных и нормальных белков. Денатурированные белки подвержены агрегации, и их накопление увеличивает риски болезней агрегации. Ненужные клетке белки подвергаются протеасомальной деградации, которой предшествует прикрепление к белку убиквитиновой метки. Мутация в гене убиквитиновой лигазы CHIP приводит к снижению продолжительности жизни. CHIP связана с инсулиновой сигнализацией у нематод и дрозофил. У мышей с генотипом CHIP -/- наблюдается синдром ускоренного старения. Рецептор инсулиноподобного фактора роста
Устные доклады 11 июля
Йенс Брунинг (Институт Макса Планка исследований метаболизма)
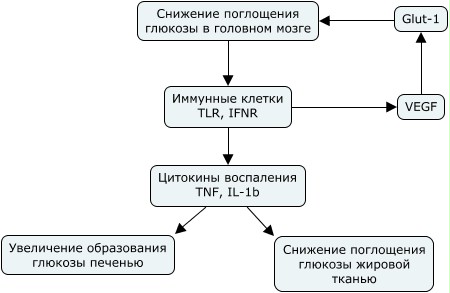
Нейроны гипоталамуса POMC и AgRP/NPY противоположным образом влияют на метаболический гомеостаз, пищевое поведение и массу тела. Они также влияют на выработку глюкозы печенью, липолиз, плотность костей, настроение и врожденный иммунитет. AgRT нейроны способствуют выработке миостатина, который в свою очередь обеспечивает системную устойчивость к инсулину. Метаболическое воспаление играет ключевую роль в регуляции поглощения глюкозы клетками.
Амита Сегал (University of Pennsylvania)
У человека возраст существенно влияет на суточные ритмы сна, отдыха и активности. В старом возрасте результаты актиграфии показывают существенное снижение актуальное время сна и «эффективность сна». Показатели «латентности сна», количество ночных пробуждений, фрагментация сна и частота дневного сна значительно увеличились в старых и старших возрастных группах.
(http://www.ncbi.nlm.nih.gov/pubmed/12126998). Подобные же изменения выявляются на модели дрозофил. (http://www.pnas.org/content/103/37/13843.full). При старении дрозофил происходит ослабление выраженности и сдвиг ритмов по времени суток. У самок эффект такого сдвига более выражен чем у самцов. В то же время центральный осциллятор (экспрессия белка PERIOD в нейронах) остается робастным даже у самых старых мух. В то же время в целой мухе
(http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3353743/). Утрата генов циркадных ритмов снижает продолжительность жизни, но не очень значительно. Мутация гена sleepless тоже уменьшает продолжительность жизни (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2771549/) Снижение уровня осцилляций светочувствительного белка CRYPTOCHROME (CRY) обнаруживается в головах старых мух как на уровне мРНК, так и на уровне белка.
Восстановление его активности путем оверэкспрессии у старых мух во всем теле усиливает амплитуду генов циркадного механизма и продолжительность жизни, сверхэкспрессия только в центральной системе не дает такого эффекта (http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3772985) Все это предполагает ведущую роль периферических нарушений ритмов при старении. Часы в периферических тканях с возрастом претерпевают спад. Действительно, периферические циркадные часы играют определяющую роль в изменении продолжительности при действии на мух ограничительной диеты (http://www.ncbi.nlm.nih.gov/pubmed/26626459). Ограничительная диета увеличивает амплитуду цикла циркадных генов в периферических тканях, в частности tim. В свою очередь постоянное освещение снижает эффективность влияния низкокалорийной диеты на продолжительность жизни,
Тамас Хорват (Медицинская школа Йеля)
Около 800 NPY/AgRP нейронов в гипоталамусе играют роль в эндокринной адаптации к низкокалорийной диете. Их функцию подавляет гормон жировой ткани лептин. В этих клетках гормоны влияют на жизненный цикл митохондрий. Грелин вызывающий чувство голода способствует расщеплению (fission) митохондрий. В то же время глюкоза и гормон сытости лептин — слиянию (fusion).
М. МакМанус (Пенсильванский университет)
Болезнь Паркинсона — нейродегенеративное заболевание, от которого страдают 1% людей старше 65 лет и 5% — свыше 80 лет. Его причиной считают гибель дофаминовых нейронов в черной субстанции головного мозга, связанное с накоплением агрегатов
P. Muñ
До тех пор пока мышечное волокно не повреждено, сателлитные клетки (стволовые клетки мышц) находятся в покоящемся состоянии. С возрастом наблюдается снижение регенеративных способностей мышц по внешним и внутренним по отношению к сателлитным клеткам причинам. Сателлитные клетки при этом из состояния покоя переходят в состояние сенесцентности, определяемое активацией гена p16. Молодые покоящиеся клетки отличаются высоким уровнем активности генов протеостаза (в частности, аутофагии). При старении в них происходит нарушение протеостаза и аутофагии. Рапамицин активизирует аутофагию в сателлитных клетках. Предобработка рапамицином улучшает приживление при пересадке этих клеток. Выключение аутофагии вызывает активизацию генов ингибиторов клеточного цикла и сенесценс. Антиоксидант Trolox снижает долю сенесцентных сателлитных клеток. Низкокалорийная диета уменьшает фиброз и активизирует аутофагию в сателлитных клетках.
Дэвид Сабатини (Whitehead Institute)
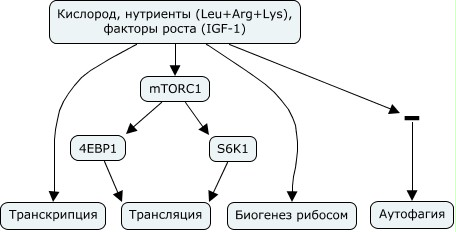
Рапамицин ингибирует высококонсервативную в эволюции киназу TOR через формирование комплекса с иммунофилином FKBP1A, который затем напрямую связывается с комплексом mTORC1, но не с mTORC2. Когда в клетку попадают аминокислоты, mTORC1 направляется к поверхности лизосом. Здесь формируется многобелковый комплекс, включающий в себя протонную помпу
У людей с индексом массы тела больше 30 в 1.5–2 раза выше частота колоректального рака. Высокожировая диета активирует PPARg, который через влияние на стволовые и прогениторные клетки способствует возникновению рака.
Дэвид Синклер (Гарвардская медицинская школа)
К старению ведет не повреждение, а реакция на повреждение. Пример — генетическая нестабильность, которая у дрожжей является следствием утраты эпигенетического сайленсинга. Причина старения — утрата аналоговой информации. Он также рассказал о роли NAD+ в долголетии:
P.L.J. de Keizer (Erasmus University Medical Center)
Повреждение ДНК приводят к образованию ДНК шрамов — эпигенетических структур, состоящих из белков FOXO4, PML и 53BP1. ДНК шрамы способствуют клеточному старению. Искусственно созданный пептид FOXO4 разрушает
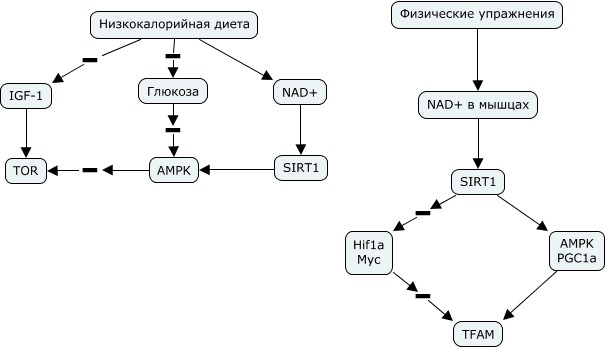
Было проведено два многолетних исследования здоровья и долголетия обезьян при действии низкокалорийной диеты — NIA (Национальным институтом старения США) и UW (Университет Висконсина). В обоих работах уровень здоровья животных существенно возрастал. В первом исследовании продолжительность жизни не менялась, во втором увеличивалась. По мнению докладчика это связано с тем, что в первом случае ограничительную диету стали применять в ранней молодости, кроме того есть отличия по составу диеты (в первой использовали животный белок, во второй — растительный). Низкокалорийная диета оказывает свое действие, влияя на транспорт электронов в митохондриях, метаболизм митохондрий, биогенез рибосом, иммунитет и воспаление. Транскриптомные сигнатуры при низкокалорийной диете и у генетических долгоживущих моделей похожи. Это касается разных моделей — дрозофил, мышей, обезьян. Сигнатура долголетия одновременно является сигнатурой здоровья.
Вальтер Лонго (UCLA)
Ингибирование
Дефект митохондриальной дыхательной цепи вызывает синдром Лея. Полногеномный CRISPR скрининг факторов, защищающих от эффектов ингибирования дыхательной цепи, выявил ответ на гипоксию и Hif1a. Хроническая гипоксия улучшает выживаемость у генетической модели синдрома Лея на мышах. Маркером дисфункции митохондрий является высокий уровень лактата.
Науке известны удивительные примеры способности к регенерации: планарии, рыбка данио, хвостатые земноводные, сердце у плода человека, уши кролика, кожа у
M. Hansen (Sanford Burnham Prebys Medical Discovery Institute)
Снижение
Старение стволовых клеток мышц определяется не только внутренними, но и внешними причинами. Одной из таких выступает утрата синтеза фибронектина, компонента внеклеточного матрикса стволовой ниши, необходимого для прикрепления клетки. Старение подавляет фокальный адгезионный аппарат, что приводит к активизации p38 и ингибированию FAK, и способствует аноикису стволовой клетки, случаю клеточной гибели, которая наступает в ответ на неправильную адгезию клеток и матрикса. Искусственная экспрессия фибронектина восстанавливает адгезию и FAK/p38 сигнализацию в старых MuSC. При этом происходит активация FAK и подавление p38.
Анн Брюне (Стенфордский университет)
При старении наблюдается увеличение уровней цитокинов воспаления в крови. В культуре сенесцентных фибробластов также увеличивается доля цитокинов воспаления. При клеточном старении меняется метаболизм аргинина (предшественник креатина) и пролина (входит в состав коллагена). В тканях старых животных больше
Эндрю Диллин (University of California at Berkeley)
Митохондрии произошли от рикетсий клады SAR11. В одной клетке человека обитает около 1000 митохондрий. У человека мтДНК кодирует 13 генов белков
M. Segel (University of Cambridge)
С возрастом умньшается количество предшественников олигодендроцитов, что способствует демиелинизации нервных волокон
Мария Бласко
Линия мышей у которых теломеры в 2 раза длиннее, живут дольше у них реже частота рака. Фермент теломераза высокоэкспрессируется в первую неделю жизни, а затем ее экспрессия резко снижается
J. Auwerx (Ecole Polytechnique Fédérale de Lausanne)
UPR (mt) приводит к деметилированию гистонов в ядре клетки и увеличению продолжительности жизни. Подавление экспрессии гена митохондриального рибосомального белка
E. Slagboom (Leiden University Medical Centre)
Признаками старения у человека являются коморбидность, полифармация и высокая гетерогенность по биовозрасту. Результаты лейденского исследования показали роль в качестве биомаркеров, связанных с риском смертности, диаметр LDL, цитрат, альбумин, VLDLD, триглицериды, MUFA, PUFA, тирозин,
D. Furman (Stanford University)
С возрастом происходит хроническое увеличение экспрессии генов инфламмасомы. Активность генов воспаления связана с жесткостью артерий, гипертонией и продолжительностью жизни. Маркерами уровней свободных радикалов являются уровни в плазме крови цистина и